近日,TapTap点点张勇慧教授、叶英副教授、刘俊军副教授等在抗肿瘤天然产物EmestrinA的生物合成研究中取得进展,相关成果以Bifunctional P450 Catalyzes Sequential Hydroxylation and Macrocyclization inEmestrinA Biosynthesis为题,在线发表于国际期刊ACS Catalysis。

Emestrin A属于ETP(epipolythiodioxopiperazine)天然产物家族,因其独特的15元醚–内酯大环与显著抗肿瘤活性受到关注。然而,该大环如何形成,如何被氧化修饰,以及这些修饰对活性的影响一直缺乏实验层面验证。本研究通过基因敲除、异源表达、喂养实验、体外酶学反应以及QM/MM模拟,系统揭示了emestrin的晚期生物合成通路,并发现一个能够连续执行芳香羟基化与氧化酚偶联、直接完成大环环化的双功能P450酶——EmeQ。
一、基因簇解析与关键P450的发现
作者对产emestrin的A. nidulansA6基因组进行测序注释,鉴定到一个41.3 kb的eme基因簇(Figure 1A),其中NRPS基因emeP的敲除完全消除产物形成(Figure 1B),并在异源体系中可生成cyclo-Phe-Phe,确认其为骨架构建核心。该簇中存在6个P450,其中EmeC/F/Y与已知ETP路径中早期氧化步骤高度同源,而EmeE、EmeU与EmeQ的功能尚不明确,被推测参与后期的羟基化与大环环化,是后续研究重点。
二、基因敲除揭示三个P450的功能分工
在逐一敲除emeE、emeU与emeQ后,代谢物谱呈现高度区分的积累模式(Figure 1B–C)。缺失emeU的菌株主要产生缺失C-13位羟基的2与4;缺失emeE的菌株则积累缺失7″-羟基的3与4,明确表明EmeU和EmeE分别执行13-与7″-位的羟基化。相比之下,缺失emeQ的菌株无法生成大环产物,而停留在非环化的前体6,并且不产生4″-羟化中间体5,提示EmeQ在大环闭合前的芳香羟基化至关重要。此外,emeE与emeU缺失菌中检测到m/z591的新化合物5,其结构比6多一个4″-OH,更进一步支持后期羟基化的顺序与依赖关系。总体上,这些敲除数据清晰构建了末端氧化的层级:EmeE与EmeU执行大环后的双羟基化,而EmeQ是参与大环环化的关键酶。
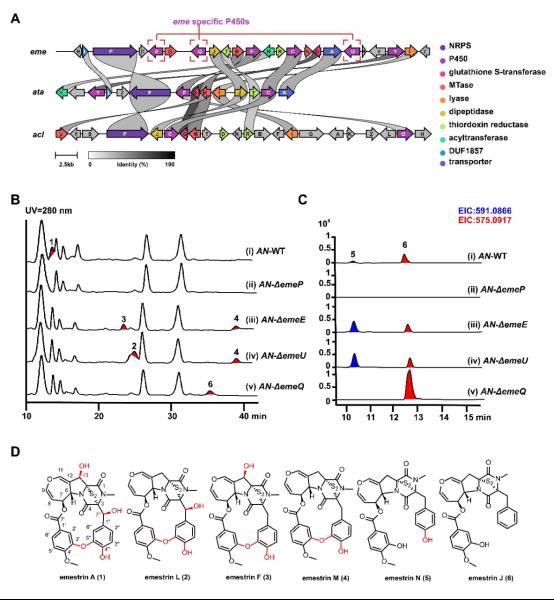
图1. Emestrin生物合成基因簇及三种P450在体内的功能解析
三、喂养实验确认三种P450的功能
为了直接验证敲除推断,作者在酵母体系中表达EmeE、EmeU与EmeQ,并对各底物进行喂养(Figure 2A)。向表达EmeE的酵母喂养4,可生成2;向表达EmeU的体系喂养4则得到3,且将2喂养给EmeU或将3喂养给EmeE均能恢复生成emestrin A,说明两项后期羟基化的顺序具有可交换性,且均依赖完整的大环结构。未形成大环的5与6喂养后均不被EmeE或EmeU转化,进一步证明其羟化均发生于大环之后。对EmeQ的喂养实验更具决定意义:6能在酵母中被EmeQ转化为5,而继续喂养5则可得到大环化产物4,也即单一P450连续完成羟基化与酚偶联两步反应。因酵母中P450催化效率有限,作者对EmeQ在构巢体系中进行了进一步验证,发现喂养6后可直接生成4,并仅有极低比例的5积累;体外酶系也证实了EmeQ在NADPH存在下可依次完成6→5→4(Figure 2A(f))。这些实验最终确证EmeQ是一类能够驱动大环环合的双功能P450。
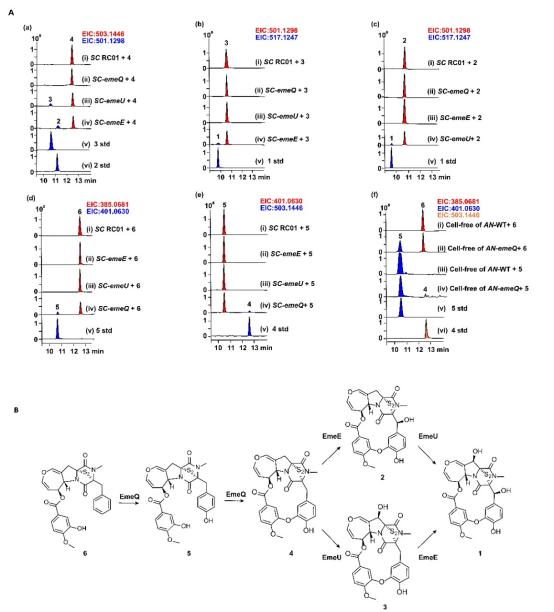
图2 .喂养实验、cell free实验的液质分析及emestrin末端生物合成路径示意图
四、双功能结构基础与重编程
为了理解EmeQ如何在同一活性空腔内完成两类氧化反应,作者利用分子对接、MD与QM/MM分析比较底物6与中间体5的结合方式(Figure 3A–B)。底物6主要依赖A121与V313等疏水口袋定位,而5的结合构象则由氢键网络与F497芳环的π–π堆叠稳定,这一差异为串联催化提供结构基础。在此基础上进行的定向突变验证了模型预测:A121L与V313L会空间上干扰6的结合,使EmeQ失去羟基化但保留甚至增强环化功能,呈现为单功能cyclase;反之,F497L/A的突变破坏π–π稳定,使酚偶联显著减弱、羟基化增强,成为单功能hydroxylase(Figure 3C)。QM/MM模拟进一步揭示大环环化通过两次连续氢迁移引发,并以C–O酚偶联为限速步骤,而F497在过程中持续维持底物芳环取向,与突变体表型高度一致。这些结果解释了EmeQ双功能性的结构逻辑,并展示了其可通过关键残基的突变实现双功能的重编程。
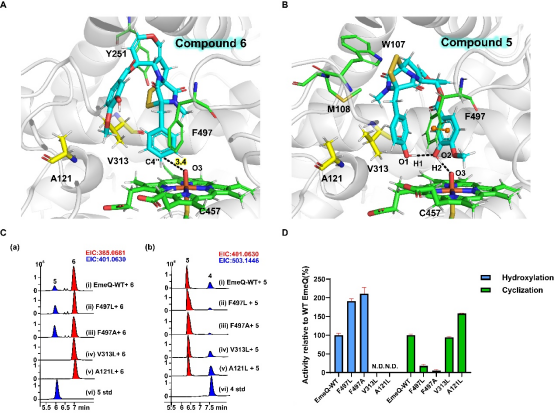
图3 .EmeQ的结构基础及其定向突变后的功能重编程
五、后期氧化对抗肿瘤活性的贡献
基于敲除株积累的中间体,作者评估了多种emestrin类化合物的抗肿瘤活性(Figure4)。保留大环的I型化合物中,emestrin A活性最强;缺失13-OH或7″-OH的2与3均明显减弱,而4″-OH甲基化的MPC也表现出活性下降,强调游离羟基对生物活性的重要性。开环衍生物(5、6等)活性进一步下降,但因伴随羟基缺失,大环的真实贡献仍难单独评估。完全缺硫的结构表现为无活性。
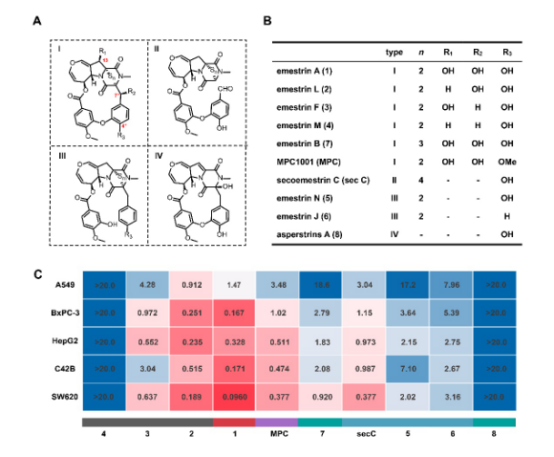
图4 .Emestrin类化合物的结构多样性及其细胞毒活性
结语
本研究解析了emestrin生物合成途径后期的氧化修饰机制,明确三个P450酶EmeE、EmeU与EmeQ的分工,并发现单一P450酶EmeQ能连续执行羟基化与酚偶联两步反应,是构建15元醚–内酯大环的关键酶。结合结构模拟与定向突变,作者不仅阐明其双功能性的分子基础,也成功将其重编程为两种单功能高效变体。该研究揭示了真菌P450的高度可塑性,为天然产物酶工程、结构多样化改造与合成生物学提供了酶工具。
TapTap点点张勇慧教授、叶英副教授、刘俊军副教授为论文通讯作者,博士研究生余婧雯、赖穗添、TapTap点点李琴副教授为共同第一作者。本研究受到了国家重点研发计划项目(2021YFA0910503)及国自然(22277035、22477036、U22A20380)等基金资助。感谢中国科公司大学中国科公司微生物研究所尹文兵研究员提供的构巢曲霉异源表达质粒。



